Pressmeddelande: Nobelpriset i fysiologi eller medicin 2000
English
Swedish
French
German

NOBELFÖRSAMLINGEN KAROLINSKA INSTITUTET
THE NOBEL ASSEMBLY AT THE KAROLINSKA INSTITUTE
9 oktober 2000
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att Nobelpriset i Fysiologi eller Medicin år 2000
Arvid Carlsson, Paul Greengard och Eric Kandel
för deras upptäckter rörande “signalöverföring i nervsystemet”
Sammanfattning
I människans hjärna finns mer än hundra miljarder nervceller. Dessa står i förbindelse med varandra genom ett oerhört komplicerat nätverk av nervtrådar. Budskap från en nervcell till en annan överförs med hjälp av olika signalsubstanser. Signalöverföringen sker i speciella kontaktpunkter, synapser. En enda nervcell kan ha tusentals kontaktpunkter med andra nervceller.
Årets tre Nobelpristagare i fysiologi eller medicin har gjort banbrytande upptäckter rörande en betydelsefull form av signalöverföring mellan olika nervceller, s k långsam synaptisk transmission. Dessa upptäckter har varit avgörande för förståelsen av hjärnans normala funktioner och hur störningar av denna signalöverföring kan orsaka neurologiska och psykiska sjukdomar. Det har i sin tur lett till utveckling av nya läkemedel.
Arvid Carlsson, Farmakologiska institutionen, Göteborgs universitet, belönas för sin upptäckt att dopamin är en signalsubstans i hjärnan och att dopamin har stor betydelse för kontroll av våra rörelser. Hans forskningsrön ledde i sin tur till insikten att Parkinsons sjukdom orsakas av dopaminbrist i vissa delar av hjärnan och till att man kunde få fram ett effektivt läkemedel (L-dopa) mot denna sjukdom. Arvid Carlsson har gjort en rad följdupptäckter som ytterligare kartlagt dopaminets roll i hjärnan. Han har bl a påvisat verkningsmekanismer för läkemedel som används för behandling av schizofreni.
Paul Greengard, Laboratory of Molecular and Cellular Neuroscience, Rockefeller University, New York, belönas för sin upptäckt av hur dopamin och en rad andra signalsubstanser utövar sina effekter i nervsystemet. Signalsubstanserna påverkar först en receptor på cellens yta. Det utlöser en kaskad av reaktioner som påverkar vissa “nyckelproteiner” som i sin tur reglerar olika funktioner i cellen. Proteinernas form och funktion förändras genom att fosfatgrupper tillförs (fosforylering) eller tas bort (defosforylering). Genom denna mekanism kan signalsubstanser överföra sina budskap mellan nervceller.
Eric Kandel, Center for Neurobiology and Behavior, Columbia University, New York, belönas för sin upptäckt av hur synapsernas effektivitet kan förändras och med vilka molekylära mekanismer detta sker. Med nervsystemet hos en havssnigel som modell har han visat att förändringar av synapsernas funktion är centralt för inlärning och minne. För uppkomsten av en form av korttidsminne spelar proteinfosforylering i synapsen en viktig roll. För att ett långtidsminne ska uppstå krävs dessutom nybildning av proteiner som bl a leder till att synapsens form och funktion förändras.
Arvid Carlsson
Dopamin viktig signalsubstans
Arvid Carlsson genomförde från slutet av 1950 talet en rad banbrytande arbeten som visade att dopamin är en viktig signalsubstans i hjärnan. Tidigare trodde man att dopamin endast var ett förstadium till en annan signalsubstans, noradrenalin. Arvid Carlsson utvecklade en förfinad kemisk analysmetod som gjorde det möjligt att med hög känslighet mäta halten av dopamin. Han fann då att dopamin var koncentrerat till andra ställen i hjärnan än noradrenalin, vilket ledde honom till slutsatsen att dopamin i sig kunde fungera som signalsubstans. Dopamin fanns i särskilt höga koncentrationer i de delar av hjärnan som kallas de basala ganglierna och som bl a har stor betydelse för att kontrollera våra muskelrörelser.
I en serie försök använde Arvid Carlsson en substans från växtriket, reserpin, som gör att synapsernas förråd av flera signalsubstanser töms ut. När han gav reserpin till försöksdjur förlorade de sin spontana rörelseförmåga. Han behandlade då dessa djur med L-dopa, ett förstadium till dopamin som i hjärnan omvandlas till dopamin. Då försvann symtomen så att försöksdjuren åter kunde röra sig normalt. Däremot förbättrades inte djur som istället behandlades med ett förstadium till signalsubstansen serotonin. Arvid Carlsson kunde också visa att behandling med L-dopa ledde till att nivåerna av dopamin i hjärnan normaliserades.
Läkemedel mot Parkinsons sjukdom
Försöksdjurens nedsatta rörelseförmåga orsakades alltså av brist på dopamin och kunde motverkas genom behandling med L-dopa. Arvid Carlsson insåg att de symtom som reserpin orsakade hos försöksdjur påminde om symtomen hos patienter med Parkinsons sjukdom. Detta ledde till att man kunde visa att patienter med Parkinsons sjukdom hade onormalt låg halt av dopamin i de basala ganglierna.
Som en följd av detta utvecklades L-dopa som läkemedel. Än i dag är L-dopa den huvudsakliga behandlingen vid Parkinsons sjukdom. Vid Parkinsons sjukdom dör dopaminproducerande nervceller i vissa delar av de basala ganglierna, vilket bl a leder till skakningar, muskelstelhet och rörelsehämning. Behandling med L-dopa, som i hjärnan omvandlas till dopamin, kan kompensera dopaminbristen och normalisera rörelseförmågan.
Antipsykotiska och antidepressiva läkemedel
Förutom den framgångsrika behandlingen av Parkinsons sjukdom har Arvid Carlssons forskningsrön ökat förståelsen för hur flera andra läkemedel verkar. Han visade att antipsykotiska läkemedel, som framför allt används mot schizofreni, påverkar signalöverföringen med dopamin genom att blockera dopaminreceptorer. Arvid Carlssons upptäckter har också haft stor betydelse för läkemedelsbehandlingen av depression, som är en av våra vanligaste folksjukdomar. Han har starkt bidragit till utvecklingen av den nya generationen antidepressiva läkemedel, s k selektiva serotoninåterupptagshämmare.
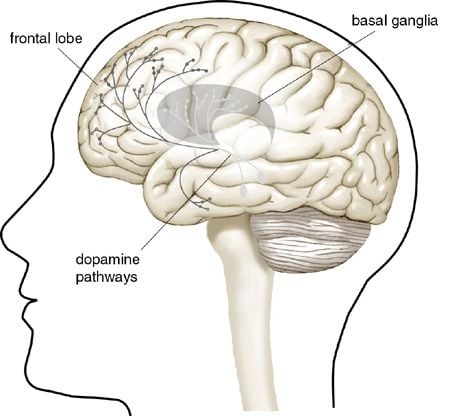 |
| Figur 1. Dopaminnervbanor i hjärnan. Arvid Carlsson visade att det fanns särskilt höga koncentrationer av signalsubstansen dopamin i hjärnans s k basala ganglier, som bl a har stor betydelse för att kontrollera våra muskelrörelser. Vid Parkinsons sjukdom dör dopaminproducerande nervceller vars nervtrådar löper till de basala ganglierna. Det orsakar symptom som skakningar, muskelstelhet och nedsatt rörelseförmåga. |
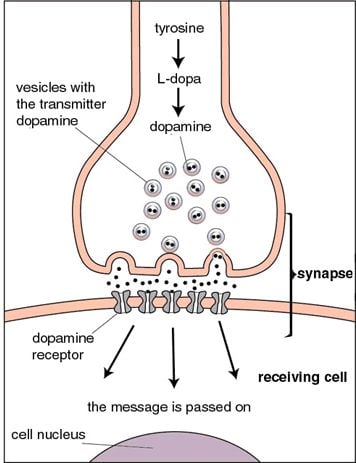
Figur 2.
Budskap från en nervcell till en annan överförs med hjälp av olika signalsubstanser. Detta sker i särskilda kontaktpunkter, synapser, mellan nervcellerna. Signalsubstansen dopamin bildas från förstadierna tyrosin och L-dopa och lagras i blåsor i nervändarna. När en nervimpuls gör att blåsorna töms påverkas dopaminreceptorer i mottagarcellens membran så att budskapet förs vidare in i cellen. Vid behandling av Parkinsons sjukdom ges läkemedlet L-dopa, som omvandlas till dopamin i hjärnan. Därmed kompenseras patientens dopaminbrist.
Paul Greengard
Långsam signalöverföring
I slutet av 1960-talet kände man till att dopamin, noradrenalin och serotonin var signalsubstanser i nervsystemet, men man saknade kunskap om hur de verkade. Paul Greengard belönas för att han visat hur dessa signalsubstanser utövar sina effekter.
Signalsubstanser som dopamin, serotonin, noradrenalin och vissa s k neuropeptider överför signalerna med vad som kallas långsam synaptisk transmisson. Då uppkommer en långvarig förändring av nervcellernas funktion, som kan vara från sekunder till timmar. Denna typ av signalöverföring ansvarar för en mängd basala funktioner i nervsystemet och är bl a av betydelse för vår vakenhetsgrad och sinnesstämning. De långsamma synaptiska signalerna kan även reglera de snabba system vars signaler möjliggör t ex tal, rörelser och sinnesintryck.
Fosforylering av proteiner förändrar nervcellens funktioner
Paul Greengard visade att den långsamma synaptiska signalöverföringen sker genom en kemisk reaktion som kallas proteinfosforylering. Den innebär att fosfatgrupper kopplas på ett protein så att dess form och därmed också funktion förändras. Paul Greengard visade att dopamin påverkar en receptor i cellens membran som höjer nivåerna av budbärarmolekylen cykliskt AMP (cAMP) inne i cellen. Den aktiverar i sin tur ett protein, proteinkinas A, som kan tillföra fosfatmolekyler till andra proteiner i nervcellen.
Dessa proteinfosforyleringar leder till att en rad proteiner med olika funktioner i nervcellen påverkas. En viktig grupp är de proteiner som bildar jonkanaler i cellens membran. De reglerar nervcellernas retbarhet och gör att nervcellen kan sända elektriska impulser längs sina förgreningar. Varje nervcell har olika typer av jonkanaler, som i hög grad bestämmer hur nervcellen ska reagera. När en typ av jonkanal fosforyleras kan därför nervcellens funktioner, t ex dess retbarhet, förändras.
DARPP-32 ett centralt reglerprotein
Paul Greengard visade senare att det i vissa nervceller sker ännu mer komplicerade reaktioner. Signalsubstansernas effekter utlöses då via en kaskad av fosforyleringar och defosforyleringar, då fosfatmolekyler istället tas bort från proteiner. Dopamin och flera andra signalsubstanser kan påverka ett reglerprotein, DARPP-32, som indirekt förändrar funktionen hos ett stort antal andra proteiner. DARPP-32-proteinet kan därför liknas vid en orkesterledare, som dirigerar en rad andra molekyler. När DARPP-32 aktiveras påverkas bl a flera typer av jonkanaler och vissa snabba synapsers funktion förändras.
Paul Greengards upptäckter om proteinfosforylering har ytterligare fördjupat förståelsen för flera läkemedels verkningsmekanismer. Effekten av de läkemedel som påverkar vissa signalsubstanser i hjärnan beror nämligen på att de specifikt förändrar fosforyleringen av proteiner i olika nervceller.
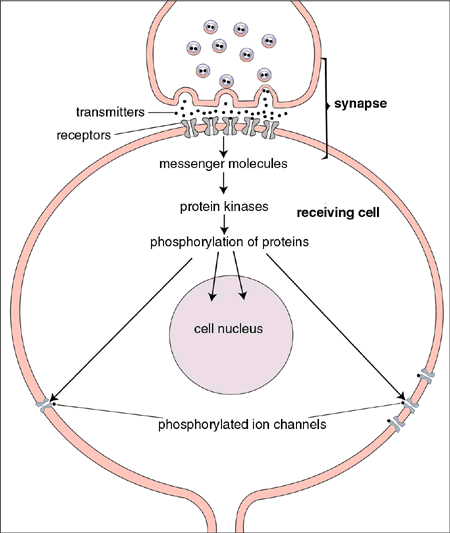 |
| Figur 3. Paul Greengard har visat hur dopamin och flera andra signalsubstanser utövar sina effekter i nervcellen. När receptorer i cellens membran påverkas av en signalsubstans höjs nivåerna av t ex budbärarmolekylen cAMP. Då aktiveras s k proteinkinaser, som gör att vissa “nyckelproteiner” fosforyleras, dvs tillförs fosfatmolekyler. Dessa proteinfosforyleringar leder till att en rad proteiner med olika funktioner i nervcellen förändras. När exempelvis proteiner i jonkanaler i cellens membran påverkas så förändras nervcellens retbarhet och förmåga att sända impulser längs sina förgreningar. |
Eric Kandel
Havssnigel modellsystem för inlärning
Fosforylering av proteiner har stor betydelse även för de upptäckter som Eric Kandel belönas för, nämligen klarläggande av de molekylära mekanismer som ger upphov till minnen. Eric Kandel började med att studera minnesfunktioner hos däggdjur, men han insåg att de var alltför komplicerade för att kunna ge förståelse av basala minnesprocesser. Han övergick därför till att undersöka ett enklare modellsystem, nervsystemet hos en havssnigel, Aplysia. Den har förhållandevis få nervceller (cirka 20 000), som dessutom är ganska stora. Den har också en enkel skyddsreflex vars ändamål är att skydda gälarna och som kan utnyttjas för att studera basala inlärningsmekanismer.
Eric Kandel fann att vissa typer av stimulering gjorde att havssnigelns skyddsreflex förstärktes. Denna förstärkning kunde kvarstå under dagar och veckor och var alltså en form av inlärning. Han kunde sedan visa att denna inlärning beror på en förstärkning av den synaps som förbinder känselnervcellen med den nervcell som aktiverar muskelgrupperna som ger upphov till skyddsreflexen.
Korttidsminne och långtidsminne
Eric Kandel visade först hur en ganska liten stimulering gav upphov till en form av korttidsminne, som verkar från minuter till timmar. Mekanismen för detta “korttidsminne” är att vissa jonkanalers funktion påverkas så att mer kalciumjoner strömmar in i nervänden. Då frisätts ökad mängd signalsubstans i synapsen och därmed förstärks reflexen. Denna omställning beror i sin tur på en fosforylering av vissa jonkanalsproteiner, dvs den molekylära mekanism som tidigare påvisats av Paul Greengard.
En kraftigare och mer långvarig retning ger hos havssnigeln upphov till en form av långtidsminne som kan kvarstå under veckor. Det beror på att stark retning leder till ökade nivåer av budbärarmolekylen cAMP och proteinkinas A. Då uppkommer signaler som gör att cellkärnan förändrar bildningen av ett stort antal proteiner i synapsen. Bildningen av vissa proteiner ökar medan tillverkningen av andra minskar. Slutresultatet blir att storleken på synapsen kan öka och därmed skapas en kvarstående förstärkning av synapsens funktion.
Långtidsminnet kräver därför till skillnad från korttidsminnet att det bildas nya proteiner. Om man blockerar denna proteinbildning i nervsystemet så blockeras också långtidsminnet, men däremot inte korttidsminnet.
Synapsförändringar (plasticitet) en förutsättning för minnet
Eric Kandel visade alltså att såväl korttidsminnet som långtidsminnet hos havssnigeln sitter i synapserna. Under 1990-talet har han även genomfört studier på bl a möss. Han har då kunnat visa att samma typ av långtidsförändringar av synapsfunktionen som man ser vid inlärning hos havssnigeln även gäller däggdjur.
Den fundamentala mekanism som Eric Kandel klarlagt är giltig även för oss människor. Vårt minne “sitter i synapserna”, och förändringar av synapserna är centrala när olika typer av minnen uppkommer. Även om vägen till att förstå våra komplicerade minnesfunktioner är lång så har Eric Kandels forskningsrön lagt en viktig grund. Man kan nu gå vidare och t ex studera hur komplexa minnesbilder lagras i vårt nervsystem och hur det är möjligt att återskapa minnet av tidigare händelser. Genom att man nu förstår väsentliga delar av de cellulära och molekylära mekanismer som gör att vi kan minnas ökar möjligheterna att utveckla läkemedel som kan förbättra minnesfunktionen hos patienter med olika demenssjukdomar.
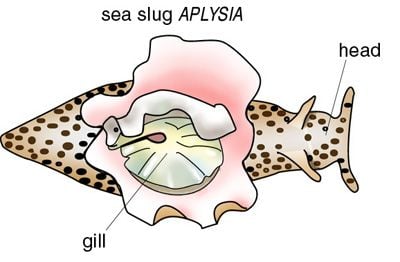
Figur 4.
En havssnigel, Aplysia, har ett enkelt nervsystem och en gälskyddsreflex som Eric Kandel utnyttjade för att studera inlärning och minne.
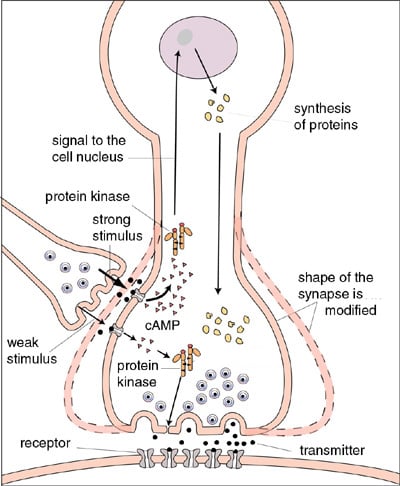 |
| Figur 5. Schematisk beskrivning av hur molekylära förändringar i synapserna skapar “korttidsminne” respektive “långtidsminne” hos havssnigeln Aplysia. Bilden visar en synaps som påverkas av en annan synaps. Korttidsminne kan uppkomma när en svag retning (smala pilar nedtill t v i figuren) leder till att proteiner fosforyleras och till att ökad mängd signalsubstans frisätts. För att ett långtidsminne ska uppstå krävs en starkare och långvarigare retning (kraftiga pilar i figuren). Då ökar nivåerna av budbärarmolekylen cAMP, som aktiverar proteinkinaser. Dessa fosforylerar olika proteiner, vilket leder till att signaler sänds till cellkärnan. Den ger i sin tur order om nybildning av proteiner, som leder till att synapsens form och funktion förändras. Synapsens effektivitet kan t ex öka genom att mer signalsubstans frisätts. |
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
