Nobelpriset i kemi 2004 – Populärvetenskaplig information
English
Swedish

Populärvetenskaplig information
6 oktober 2004
En mänsklig cell innehåller hundratusentals olika proteiner. Dessa har en rad olika och viktiga funktioner: som påskyndare av kemiska reaktioner i form av enzymer, som signalsubstanser i form av hormoner, som viktiga aktörer i immunförsvaret i form av antikroppar och genom att stå för form och struktur i cellen. Årets pristagare i kemi, Aaron Ciechanover, Avram Hershko och Irwin Rose, har bidragit med grundläggande kemisk kunskap om hur cellen kan reglera förekomsten av ett visst protein genom att märka ut oönskade proteiner med en etikett bestående av polypeptiden ubiquitin. Märkta proteiner bryts sedan snabbt ner i cellulära “avfallskvarnar” som kallas proteasomer.
Genom upptäckten av detta reglersystem för proteiner har Aaron Ciechanover, Avram Hershko och Irwin Rose gjort det möjligt att på molekylär nivå förstå hur cellen kontrollerar en rad mycket viktiga biokemiska processer såsom cellcykeln, reparation av DNA, transkription av gener samt kvalitetskontroll av nytillverkade proteiner. Denna form av styrd proteindöd har också bidragit till att förklara hur immunförsvaret fungerar. Defekter i systemet kan leda till en rad olika sjukdomar inkluderande olika typer av cancer.
Dödsmärkning av proteiner
Nedbrytning kräver väl inte energi – eller?
Medan stor uppmärksamhet och mycket forskning ägnats åt att förstå hur cellen kontrollerar syntesen av ett visst protein – åtminstone fem olika Nobelpris har utdelats inom detta område – har motsatsen, dvs. nedbrytningen av proteiner, länge ansetts mindre viktig. Man kände tidigt till en rad enkla proteinnedbrytande enzymer, t.ex. trypsin, som i tunntarmen bryter ner proteiner i vår föda till aminosyror. Likaså studerade man länge en typ av cellorganeller, lysosomer, i vilka proteiner som cellen tagit upp utifrån bryts ner. Gemensamt för dessa processer är att de inte kräver energi för att fungera.
Experiment utförda redan på 1950-talet visade dock att nedbrytning av cellens egna proteiner kräver energi. Detta förbryllade länge forskarna och det är just denna paradox som ligger bakom årets Nobelpris i kemi: att det krävs energi för nedbrytningen av proteiner inuti cellerna medan övrig proteinnedbrytning sker utan energitillförsel. Ett första steg för att komma närmare en förklaring av den energiberoende proteinnedbrytningen togs av Goldberg och medarbetare som 1977 utarbetade ett cellfritt extrakt från omogna röda blodkroppar, retikylocyter, vilket katalyserar nedbrytningen av onormala proteiner på ett ATP-beroende sätt (ATP = adenosintrifosfat, cellens energivaluta).
Genom att använda ett sådant extrakt lyckades Aaron Ciechanover, Avram Hershko och Irwin Rose i en rad epokgörande biokemiska studier under sent 1970-tal och tidigt 1980-tal visa att proteinnedbrytningen i cellerna sker i en serie stegvisa reaktioner vilka resulterar i att de proteiner som ska förstöras märks med polypeptiden ubiquitin. Denna process gör det möjligt för cellen att med hög specificitet bryta ner oönskade proteiner. Det är alltså denna reglering som kräver energi. Till skillnad från reversibla proteinmodifieringar som t.ex. fosforylering (Nobelpris i fysiologi eller medicin 1992) är reglering genom polyubiquitinering ofta irreversibel eftersom målproteinet bryts ner. En stor del av arbetet utfördes under en serie sommarledigheter som Avram Hershko och Aaron Ciechanover från Technion (Israel Institute of Technology) tillbringade hos Irwin Rose vid Fox Chase Cancer Center i Philadelphia, USA.
Etiketten heter ubiquitin
Den molekyl som senare skulle visa sig vara själva den etikett som märker ut ett protein för nedbrytning isolerades redan 1975. Denna 76 aminosyror långa polypeptid isolerades från kalvbräss och antogs delta vid bildandet av vita blodkroppar. Eftersom man senare fann molekylen i en mängd olika vävnader och organismer – dock inte i bakterier – fick den namnet ubiquitin (som betyder allmänt förekommande).
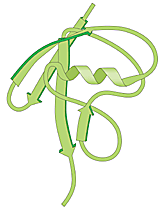 |
| Högupplöst bild (jpeg 184 kB) |
| Fig 1. Ubiquitin – en vanlig polypeptid i cellen som fungerar som själva “dödskyssen”. |
Upptäckten av ubiquitinmedierad proteinnedbrytning
Avram Hershko hade efter sin doktorsexamen studerat energiberoende proteinnedbrytning i leverceller, men beslöt 1977 att övergå till det ovan beskrivna retikylocytextraktet. Detta extrakt innehöll stora mängder hemoglobin vilket störde experimenten. I sina försök att med hjälp av kromatografi avlägsna hemoglobinet upptäckte Aaron Ciechanover och Avram Hershko att extraktet kunde delas upp i två fraktioner vilka var för sig var inaktiva. Men det visade sig att så fort man återförenade de två fraktionerna, satte den ATP-beroende proteinnedbrytningen igång igen. År 1978 rapporterade man att den aktiva komponenten i den ena fraktionen var en värmestabil polypeptid med en molekylvikt på endast 9 000 som man kallade APF-1 (= aktiv princip i fraktion 1). Detta protein visades senare vara just ubiquitin.
Det avgörande genombrottet i forskningen rapporterades i två arbeten som Ciechanover, Hershko och Rose publicerade 1980. Fram till dess var funktionen hos APF-1 helt okänd. I det första arbetet visade man att APF-1 bands kovalent, dvs. med en mycket stabil kemisk bindning, till olika proteiner i extraktet. I det andra arbetet visade man vidare att flera APF-1 molekyler kunde bindas till samma målprotein; man kallade det senare fenomenet polyubuquitinering. Vi vet nu att just polyubiquitinering av substratproteiner är den utlösande signal som leder till proteinets nedbrytning i proteasomen. Det är denna reaktion som utgör själva märkningen, “dödskyssen” om man så vill.
Dessa helt oväntade upptäckter ändrade i ett slag förutsättningarna för det fortsatta arbetet; nu kunde man koncentrera sig på att identifiera det enzymsystem som binder samman ubiquitin med dess målproteiner. Eftersom ubiquitin är så allmänt förekommande i olika vävnader och organismer insåg man snabbt att ubiquitinmedierad proteinnedbrytning måste ha en generell betydelse för cellen. Vidare gissade man att energibehovet i form av ATP ger möjlighet för cellen att kontrollera processens specificitet.
Fältet låg nu öppet och under perioden 1981–1983 utarbetade Ciechanover, Hershko, Rose tillsammans med deras post docs och studenter “the multistep ubiquitin-tagging hypothesis” baserad på tre nyupptäckta enzymaktiviteter som man kallade E1, E2 och E3 (fig. 2). I dag vet vi att en typisk däggdjurscell innehåller ett eller ett par olika E1-enzym, något fler E2-enzym och flera hundra olika E3-enzym. Det är E3-enzymens specificitet som avgör vilka proteiner i cellen som ska märkas för destruktion i proteasomen.
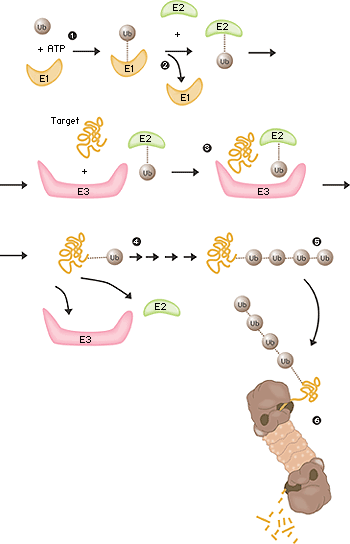
Fig 2. Ubiquitinmedierad nedbrytning
- Enzymet E1 aktiverar ubiquitin-molekylen. Denna reaktion kräver energi i form av ATP.
- Ubiquitin-molekylen förs över till ett annat enzym, E2.
- Enzymet E3 har förmågan att känna igen det protein som ska förstöras. Likaså fäster E2-ubiquitin-komplexet så nära proteinet att själva ubiquitin-etiketten kan föras över från E2 till proteinet.
- Enzymet E3 släpper nu taget om det ubiquitin-märkta proteinet.
- Detta sista steg upprepas tills proteinet har en kort kedja av ubiquitin-molekyler fäst till sig.
- Denna ubiquitin-kedja känns igen i proteasomens öppning. Ubiquitin-etiketten kopplas loss och proteinet släpps in och hackas i småbitar.
Alla studier fram till nu hade gjorts i cellfria system. För att även kunna studera den fysiologiska funktionen av ubiquitinmedierad proteinnedbrytning utarbetade Avram Hershko och hans medarbetare en immunkemisk metod. Genom att använda antikroppar mot ubiquitin kunde man isolera ubiquitin-protein-konjugat från celler där cellproteinerna hade pulsmärkts med en radioaktiv aminosyra som inte finns i ubiquitin. Resultaten visade att celler verkligen bryter ned felaktiga proteiner med hjälp av ubiquitin-systemet och vi vet nu att upp till 30% av nysyntetiserade proteiner i en cell bryts ner via proteasomen eftersom de inte klarar cellens rigorösa kvalitetskontroll.
Proteasomen – cellens avfallskvarn
Vad är en proteasom? En mänsklig cell innehåller cirka 30 000 proteasomer. Dessa tunnformade strukturer kan bryta ner i stort sett alla proteiner till peptider som är 7–9 aminosyror långa. Den aktiva ytan i proteasomen sitter inne i tunnan där den är avskärmad från resten av cellen. Enda vägen in till aktiva ytan är genom “locket”, vilket känner igen polyubiquitinerade proteiner, denaturerar dem med hjälp av ATP energi och släpper in proteinet i tunnan för nedmontering sedan först ubiquitin-etiketten avlägsnats. De peptider som bildas släpps ut från proteasomens andra ända. Proteasomen själv kan alltså inte välja mellan olika proteiner utan det är främst E3-enzymet som genom att ubiquitin-etikettera rätt protein väljer ut det för nedbrytning (fig. 3).
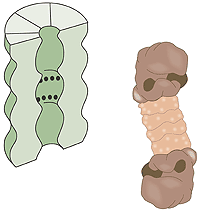 |
| Högupplöst bild (jpeg 187 kB) |
| Fig 3. Cellens”avfallskvarn”, proteasomen. De svarta punkterna indikerar aktiva, proteinnedbrytande ytor. |
Utan kvalitetskontroll blir det produktionsstopp
När de biokemiska mekanismerna bakom den ubiquitinmedierade proteinnedbrytningen var klarlagda omkring 1983 hade man ännu inte insett dess fulla fysiologiska betydelse. Att den har betydelse i att förstöra felaktiga intracellulära proteiner visste man, men för att komma vidare behövde man en cell som var muterad i ubiquitinsystemet. Genom att noga studera hur den muterade cellen skiljer sig från en normal cell under olika tillväxtbetingelser hoppades man kunna få en bättre uppfattning om vilka reaktioner i cellen som är beroende av ubiquitin-systemet.
En sådan muterad muscell isolerades 1980 av en forskargrupp i Tokyo. Deras muscell-mutant innehöll ett protein som på grund av mutationen var temperaturkänsligt. Vid lägre temperatur fungerade proteinet som det skulle men vid högre temperatur slutade det fungera. När cellerna odlades vid den högre temperaturen slutade de växa. Cellerna uppvisade dessutom defekt DNA-syntes och andra felaktiga funktioner vid den högre temperaturen. Forskare i Boston kunde snabbt visa att det värmekänsliga proteinet i muscell-mutanten var det ubiquitin-aktiverande enzymet E1. Uppenbarligen var ubiquitin-aktiveringen nödvändig för att cellen överhuvudtaget skulle fungera och föröka sig. Denna kontollerade proteinnedbrytning var alltså inte bara viktig för att bryta ner felaktiga proteiner i cellen utan deltog sannolikt även i kontrollen av cellcykeln, DNA-replikation och kromosomstruktur.
Från sent 1980-tal och framåt har en rad fysiologiskt viktiga substrat för ubiquitinmedierad proteinnedbrytning identifierats och här kommer endast några få av de viktigaste att nämnas.
Förhindrande av självpollinering hos växter
De flesta växter är tvåkönade, hermafroditer. Självpollinering leder till en gradvis minskning av den genetiska variabiliteten vilket på sikt kan medföra att hela arten dör ut. För att förhindra detta använder sig växter av ubiquitinmedierad proteinnedbrytning för att avstöta “själv”-pollen. Den exakta mekanismen är ännu inte klarlagd men E3-enzymet har påträffats och när man tillsatt proteasomhämmare har avstötningen försämrats.
Reglering av cellcykelnNär en cell ska göra en kopia av sig själv, är det många kemiska reaktioner inblandade. För en människa rör det sig om sex miljarder baspar som ska dupliceras i DNA. Dessa ligger samlade i 23 kromosompar som ska kopieras. Den vanliga celldelningen, mitosen, liksom bildandet av könsceller, meiosen, har många beröringspunkter med årets Nobelpris. Det ansvariga E3-enzymet, ett proteinkomplex som kallas “anaphase-promoting complex” (APC), kontrollerar att cellen går ut ur mitosen. Enzymkomplexet har även visat sig ha en viktig roll vid separationen av kromosomerna under mitos och meios. Ett annat proteinkomplex fungerar som ett rep kring kromosomparen och håller samman dem. Vid en given signal ubiquitinmärker APC en hämmare av ett visst proteinnedbrytande enzym varpå hämmaren förs till proteasomen och blir förstört. Enzymet blir fritt, aktiveras och klipper upp repet kring kromosomparen. I och med att repet är borta kan kromosomparen separeras. Felfördelning av kromosomerna under meiosen är den vanligaste orsaken till spontana missfall under graviditeten och en extra kromosom 21 hos människa leder till Downs syndrom. De flesta elakartade tumörer har celler med förändrat kromosomantal som ett resultat av felfördelning av kromosomerna under mitosen. |
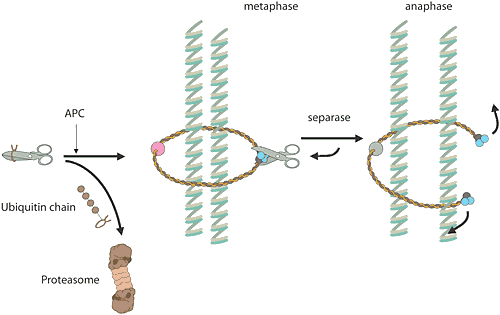 |
| Högupplöst bild (jpeg 230 kB) |
DNA-reparation, cancer och programmerad celldöd
Proteinet p53 har kallats “genomets väktare” och det är ett s.k. tumörsupressorprotein. Det betyder att så länge en cell kan tillverka p53 försvåras uppkomsten av cancer. Proteinet är följdriktigt muterat i minst 50 % av alla humana cancer. Mängden p53-protein i en normal cell är låg till följd av en kontinuerlig tillverkning och nedbrytning. Nedbrytningen regleras genom ubiquitinering och det ansvariga E3-enzymet bildar ett komplex med p53-proteinet. Efter en DNA-skada fosforyleras p53-proteinet och det gör att det inte längre binder till sitt E3-enzym, nedbrytningen avstannar och mängden p53-protein i cellen höjs snabbt. p53-proteinet fungerar som en transkriptionsfaktor. En transkriptionsfaktor är ett protein som reglerar uttrycket av en viss gen. p53-proteinet binder till och kontrollerar gener som reglerar reparation av DNA och programmerad celldöd. Höjda nivåer av p53-protein leder först till stopp i cellcykeln för att ge tid till reparation av en DNA-skada. Om skadan är för omfattande utlöser cellen programmerad celldöd och “begår älvmord”.
Infektion med humant papillom-virus är starkt korrelerad till uppkomsten av livmoderhalscancer. Viruset undgår kontrollfunktionen hos p53-proteinet genom att ett virusprotein aktiverar och ändrar igenkänningsmönstret hos ett visst cellulärt E3-enzym, E6-AP, vilket luras att ubiquitinera p53-proteinet som helt förstörs. Till följd av detta kan den infekterade cellen inte längre reparera DNA-skador på ett normalt sätt eller utlösa programmerad celldöd, mutationerna i DNA blir allt fler och slutligen kan detta leda till cancerutveckling.
Immun- och inflammationsreaktioner
En viss transkriptionsfaktor reglerar många av de gener i cellen som är viktiga för immunförsvar och inflammationsreaktioner. Denna transkriptionsfaktor förekommer bundet till ett hämmarprotein i cellens cytoplasma och den bundna formen saknar aktivitet. När celler utsätts för bakterier eller en rad olika lokala signalsubstanser fosforyleras hämmarproteinet och det medför att det ubiquitineras och bryts ner i proteasomen. Den frisläppta transkriptionsfaktorn transporteras till cellkärnan där den binder till och aktiverar uttryck av specifika gener.
Ubiquitin-proteasomsystemet tillverkar även de peptider som presenteras av immunförsvaret på ytan av en virus-infekterad cell genom att bryta ned virusproteiner till lämplig storlek. T-lymfocyter känner igen dessa peptider och angriper cellen som ett viktigt led i vårt försvar mot virusinfektioner.
Cystisk fibros (CF)
Den ärftliga sjukdomen Cystisk fibros, CF, orsakas av en icke-fungerande plasmamembran-kloridkanal som kallas CFTR, “cystic fibrosis transmembrane conductance regulator”. De flesta CF-patienter har en och samma genetiska skada, en förlust av aminosyran fenylalanin i CFTR-proteinet. Mutationen förorsakar felveckning av proteinet och det i sin tur leder till att allt protein hålls kvar av cellens kontrollsystem för proteinkvalitet. Systemet ser till att det felveckade proteinet förstörs genom ubiquitinmedierad proteinnedbrytning i stället för att transporteras ut till cellväggen. En cell som saknar en fungerande kloridkanal kan inte längre transportera kloridjoner genom cellväggen. Detta påverkar sekretionen i bl.a. lunga och leder till ansamling av ett segt sekret i lungan vilket försämrar funktionen och starkt ökar risken för infektion.
Ubiquitinsystemet har blivit ett intressant forskningsområde för läkemedel mot olika sjukdomar. Sådana preparat kan riktas mot komponenter av det ubiquitinmedierade proteinnedbrytningssystemet för att hindra nedbrytningen av specifika proteiner. De kan även utformas så att de får systemet att förstöra oönskade proteiner. En medicin som redan testas kliniskt är proteasomhämmaren Velcade (PS341) som används mot multipelt myelom, en cancersjukdom som berör de antigen-producerande cellerna i kroppen.
Årets pristagare har förklarat den molekylära bakgrunden till ett för alla högre celler mycket viktigt regleringssystem för proteiner. Nya cellfunktioner som styrs av ubiquitinmedierad proteinnedbrytning upptäcks hela tiden och denna forskning pågår i ett stort antal laboratorier över hela världen.
| Pristagarna | |
| Aaron Ciechanover | |
| Technion (Israel Institute of Technology) Rappaport Institute 1 Efron Street P.O. Box 9697 Haifa 31096 Israel |
Israelisk medborgare, född 1947 (57 år) i Haifa, Israel. Doktorsgrad i medicin 1975 vid Hebrew University of Jerusalem, och i biologi 1982 vid Technion (Israel Institute of Technology), Haifa. Distinguished Professor vid Center for Cancer and Vascular Biology, the Rappaport Faculty of Medicine and Research Institute at the Technion, Haifa, Israel. |
| Avram Hershko | |
| Technion (Israel Institute of Technology) Rappaport Institute 1 Efron Street P.O. Box 9697 Haifa 31096 Israel |
Israelisk medborgare, född 1937 (67 år) i Karcag, Ungern. Doktorsgrad i medicin 1969 vid Hadassah and the Hebrew University Medical School, Jerusalem. Distinguished Professor vid avdelningen för biokemi, Rappaport Family Institute for Research in Medical Sciences at the Technion, Haifa, Israel. |
| Irwin Rose | |
| Dept. of Physiology and Biophysics College of Medicine University of California, Irvine Irvine, CA 92697 USA |
Amerikansk medborgare. Född 1926 (78 år) i New York, USA. Doktorsgrad 1952 vid University of Chicago, USA. Specialist vid avdelningen för fysiologi och biofysik på College of Medicine, University of California, Irvine, USA. |
Illustrationer: Typoform
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 12 laureates' work and discoveries range from proteins' structures and machine learning to fighting for a world free of nuclear weapons.
See them all presented here.
