Pressmeddelande: Nobelpriset i fysiologi eller medicin 2006
English
Swedish
![]()
2 oktober 2006
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att
Nobelpriset i Fysiologi eller Medicin år 2006 gemensamt tilldelas
Andrew Z. Fire och Craig C. Mello
för deras upptäckt av “RNA-interferens – utsläckning av geners uttryck med dubbelsträngat RNA”
Sammanfattning
Årets Nobelpristagare i fysiologi eller medicin har upptäckt en mekanism av central betydelse för informationsflödet i cellen. Vår arvsmassa styr livsprocesserna genom ett flöde av information från DNA i cellkärnan via budbärarmolekylen mRNA (messenger-RNA) till bildningen av proteiner i cellens cytoplasma. De amerikanska forskarna Andrew Fire (f 1959) och Craig Mello (f 1960) publicerade 1998 att de upptäckt en process som kan bryta ner mRNA för en viss gen. Mekanismen kallas RNA-interferens och aktiveras av RNA-molekyler i dubbelsträngad form.
Med hjälp av ett särskilt biokemiskt maskineri dirigerar de dubbelsträngade RNA-molekylerna nedbrytningen av motsvarande mRNA-molekyler. På så sätt kan uttrycket av den gen som kodar för ett visst protein släckas ut (gene silencing). Resultatet blir att bildningen av detta protein stängs av.
RNA-interferens förekommer hos såväl växter som djur inklusive människan. Den har stor betydelse för regleringen av våra gener, deltar i skyddet mot virusinfektioner och håller hoppande element i arvsmassan i schack. RNA-interferens används idag som en viktig metod inom grundforskningen för att studera enskilda geners funktion. Upptäckten av RNA-interferens kan också öppna nya behandlingsmöjligheter inom medicinen.
Från DNA via RNA till protein
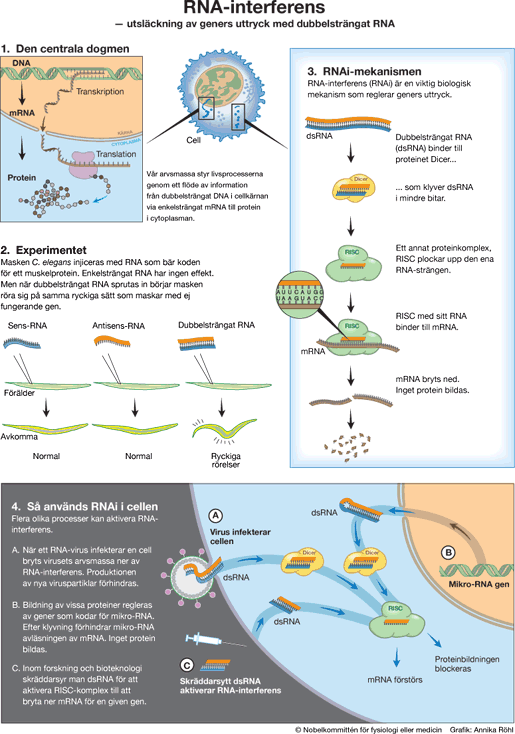
Den genetiska koden i arvsmassans DNA bestämmer hur proteiner bildas, och proteinerna svarar för livsprocesserna – alltifrån matsmältningens enzymer till nervsystemets receptorer. Koden kopieras från DNA till mRNA, som används när proteinerna byggs enligt de instruktioner som lagrats i DNA:s genetiska kod. På så sätt flödar informationen från DNA via mRNA till protein (Figur 1). Detta flöde brukar betecknas som molekylärbiologins centrala dogm, efter en formulering av den brittiske Nobelpristagaren Francis Crick.
Vår arvsmassa består av cirka 30 000 gener men alla används inte i varje cell. Vissa gener är tysta medan andra uttrycks, dvs styr bildning av nya proteiner. I förlängningen leder detta till att celler och organ utvecklas och förnyas. Man har sedan länge känt till att genuttrycket styrs av det s k transkriptions-maskineriet som kopierar DNA till mRNA. Detta kan i sin tur regleras av olika faktorer.
De grundläggande principerna för genreglering identifierades för mer än 40 år sedan av de franska Nobelpristagarna François Jacob och Jacques Monod. Vi vet idag att liknande principer fungerar genom hela evolutionen, från bakterier till människor. De utgör också en förutsättning för genteknologin. När man för in en DNA-sekvens i en cell översätts den till mRNA, och slutprodukten blir det protein som DNA-sekvensen kodar för.
Svårförklarliga resultat
Omkring år 1990 framkom oväntade vetenskapliga resultat som tedde sig svårförklarliga. De mest dramatiska effekterna observerades av växtforskare som försökte förstärka färgen i petunior. De förde in en gen som styr bildningen av rött färgpigment – men resultatet blev att blommorna helt tappade färgen! Hur sådana effekter uppstod förblev en gåta tills den fick sin lösning genom den upptäckt som belönas med årets Nobelpris.
Upptäckten av RNA-interferens
Andrew Fire och Craig Mello undersökte i mitten av 90-talet hur genuttrycket regleras i rundmasken Caenorhabditis elegans (Figur 2). De sprutade in mRNA-molekyler som kodar för ett protein som har betydelse för maskens rörelseförmåga. Man såg dock inga effekter. De injicerade då RNA som kan binda till motsvarande mRNA, s k antisens-RNA. Inte heller då hände något. Men när Fire och Mello sprutade in både mRNA och antisens-RNA på samma gång visade maskens avkomma upp ett besynnerligt, ryckande rörelsemönster. Ett liknande beteende förekom hos maskar som helt saknade genen för muskelproteinet. Vad hade inträffat?
När mRNA och antisens-RNA band sig till varandra bildade de dubbelsträngat RNA. Var det möjligen så att ett dubbelsträngat RNA kunde tysta den gen som bar samma kod som just detta RNA? Man testade hypotesen genom att spruta in dubbelsträngat RNA med genetisk kod för några andra maskgener. I alla dessa fall blev resultatet att just den gen vars kod man använt släcktes ut. Det protein som genen kodade för upphörde att bildas. Dubbelsträngat RNA kunde alltså påverka – interferera med – genernas uttryck, ett fenomen som kom att kallas RNA-interferens.
Genom en serie enkla men eleganta experiment kunde Fire och Mello sluta sig till att dubbelsträngat RNA släcker ut gener och att RNA-interferens är specifik för den gen vars kod överensstämmer med RNA-molekylens. De fann också att RNA-interferens kan spridas mellan celler och till och med ärvas till avkomman. Det räckte att injicera små mängder dubbelsträngade RNA-molekyler för att få effekt, och Fire och Mello föreslog därför att enzymer deltar i RNA-interferensen.
Fire och Mello publicerade sina fynd i tidskriften Nature den 19 februari 1998. Deras upptäckt klargjorde en rad förbryllande resultat och blev startskottet för ett helt nytt forskningsfält.
Maskineriet för RNA-interferens identifieras
Under de följande åren identifierades de olika komponenterna i RNA-interferens-maskineriet (Figur 3). Dubbelsträngat RNA binder till ett proteinkomplex, Dicer, som klyver RNA i mindre fragment. Dessa kopplas ihop med ett annat proteinkomplex, RISC. Den ena RNA-strängen elimineras, medan den andra fungerar som avsökningssond och kopplar ihop RISC med mRNA-molekyler. När sådant mRNA bundit till det RNA som sitter på RISC bryts det ner och elimineras. Den gen som detta mRNA är budbärare för har därmed släckts ut.
RNA-interferens – ett försvar mot virus och hoppande gener
RNA-interferens är betydelsefull i försvaret mot virusinfektioner, särskilt hos lägre organismer. Många virus har en arvsmassa som består av RNA. Vid en virusinfektion kommer virus-RNA in och dubbelsträngat RNA produceras i cellen (Figur 4A). Den binds då till Dicer och kapas till mindre fragment. RISC-komplexet aktiveras, virus-RNA bryts ner, och cellen överlever infektionen. Människan och andra högre organismer har skapat ett ännu effektivare försvar – immunsystemet med dess interferoner, antikroppar och T-celler.
Hoppande gener, transposoner, är DNA-sekvenser som kan flytta runt i arvsmassan. De finns i alla organismer och kan orsaka skada om de hamnar på fel plats. När transposonerna flyttar omkring sker det ofta genom att transposon-DNA kopieras till RNA, som sedan översätts till DNA och sätts in på en annan plats i arvsmassan. En del av RNA-molekylen är ofta dubbelsträngad, och den kan då brytas ner av RNA-interferens-maskineriet. På så sätt kan RNA-interferens skydda arvsmassan mot transposonernas aktivitet.
RNA-interferens reglerar genuttryck
Människans celler, liksom maskens, använder RNA-interferens-maskineriet för att styra geners uttryck (Figur 4B). Hundratals gener i vår arvsmassa kodar för små RNA-molekyler som kallas mikro-RNA. Dessa innehåller avsnitt av andra geners kod. En mikro-RNA-molekyl kan tvinna ihop sig och bilda dubbelsträngat RNA. Därigenom aktiverar den komponenter i RNA-interferens-maskineriet till att bryta ner mRNA-budbärare från den gen som har en liknande kod, eller blockera avläsningen av mRNA. Resultatet blir att uttrycket av denna gen släcks ut så att proteinet inte kan bildas. Denna form av genreglering genom mikro-RNA har visat sig spela en viktig roll i organismens utveckling och för styrningen av cellernas funktioner.
Nya möjligheter inom forskning, genteknologi och sjukvård
RNA-interferens öppnar spännande möjligheter för genteknologin. Man har skräddarsytt RNA-molekyler, s k silencing RNA, som kan aktivera nedbrytning av kroppseget mRNA (Figur 4C). Silencing RNA-molekyler förs in i cellen och aktiverar RNA-interferens. De kroppsegna mRNA-molekyler som kan binda till silencing RNA förstörs.
RNA-interferens har redan fått stor användning i den biologiska och medicinska forskningen som en kraftfull metod för att kartlägga geners funktioner. Man hoppas att principen så småningom också ska kunna användas för medicinsk behandling, växtförädling mm. Många sjukdomar kan behandlas genom att dämpa vissa geners aktivitet. Nyligen har man i försöksdjur bl a lyckats att med RNA-interferens släcka ut en gen som leder till hög kolesterolhalt. Forskarna har stora förhoppningar om att i framtiden kunna använda RNA-interferens för att behandla exempelvis virusinfektioner, hjärtkärlsjukdomar, cancer och ämnesomsättningssjukdomar.
Referens:
A. Fire, S.Q. Xu, M.K. Montgomery, S.A. Kostas, S.E. Driver & C.C. Mello: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391:806-811.
Andrew Z. Fire, född 1959, amerikansk medborgare, PhD i biologi 1983, Massachusetts Institute of Technology, Cambridge, MA, USA. Professor i patologi och genetik, Stanford University School of Medicine, Stanford, CA, USA.
Craig C. Mello, född 1960, amerikansk medborgare, PhD i biologi 1990, Harvard University, Boston, MA, USA. Professor i molekylärmedicin och Howard Hughes Medical Institute Investigator, Program in Molecular Medicine, University of Massachusetts Medical School, Worcester, MA, USA.
Nobel Prizes and laureates
See them all presented here.
