Nobelpriset i kemi 2001 – Populärvetenskaplig information
English
Swedish

10 oktober 2001
Tre forskare delar årets Nobelpris i kemi: Dr William S. Knowles, som varit verksam vid Monsanto Company, St. Louis, Missouri, USA, professor Ryoji Noyori, Nagoya University, Chikusa, Nagoya, Japan samt professor K. Barry Sharpless, The Scripps Research Institute, La Jolla, Kalifornien, USA. De tre organiska kemisterna får priset “för utvecklandet av katalytisk asymmetrisk syntes”. Deras insatser har mycket stor betydelse för den akademiska forskningen och för framtagning av nya läkemedel och material. De används i många industriella synteser av läkemedel och andra biologiskt aktiva ämnen. Här ges en bakgrund och beskrivning av forskarnas prisbelönade upptäckter.
Spegelbildskatalys
Kirala molekyler
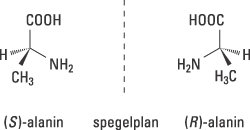
Årets Nobelpris i kemi handlar om hur vissa s.k. kirala molekyler kan användas för att påskynda och styra viktiga kemiska reaktioner. Ordet kiral härstammar från grekiskans cheir, som betyder hand. Våra händer är kirala – vår högra hand är en spegelbild av den vänstra – liksom flertalet av livets molekyler. Om vi t.ex. studerar den vanliga aminosyran alanin (Fig. 1), ser vi att den kan förekomma i två olika former, (S)-alanin resp. (R)-alanin, som är spegelbilder av varandra.
Högupplöst bild (jpeg 45kB)
Figur 1. Kiraliteten hos aminosyran alanin illustreras med modeller av dess båda former som är spegelbilder av varandra. De betecknas med (S) och (R).
Hur vi än vrider och vänder på en av formerna, kan vi inte få den att överlappa den andra. De har uppenbarligen olika tredimensionella strukturer. Detta beror på att kolatomen i mitten binder fyra olika grupper, CH3, NH2, COOH och H vilka är placerade i hörnen av en tetraeder. De heldragna bindningarna till NH2 och COOH indikerar att dessa bindningar ligger i papprets plan, medan den kilformade svarta bindningen och den kilformade streckade bindningen visar, att de är riktade utåt respektive inåt från papprets plan.
Det var den holländske kemisten J. H. van ‘t Hoff och den franske kemisten J. A. Le Bel som oberoende av varandra år 1874 upptäckte det tetraedriska arrangemanget av grupperna runt den centrala kolatomen. (van ‘t Hoff belönades för övrigt med det första Nobelpriset i kemi år 1901, men för andra upptäckter.)
Aminosyran alanin förekommer alltså i två former, s.k. enantiomerer. Då man i laboratoriet under vanliga förhållanden framställer alanin får man en blandning där hälften är (S)-alanin och hälften är (R)-alanin. Syntesen är symmetrisk i den meningen att den ger lika mycket av de båda enantiomererna.
Asymmetrisk syntes, å andra sidan, handlar om att kunna framställa den ena formen i överskott. Varför är det så viktigt? Låt oss gå tillbaka till naturen för att finna svaret.
Naturen är kiral
Man kan ju tycka att de båda formerna av kirala molekyler borde vara lika vanliga i naturen, reaktionerna borde vara symmetriska. Ändå visar det sig när vi studerar cellernas molekyler i närbild, att naturen huvudsakligen utnyttjar den ena av de båda enantiomererna. Därför har vi – och det gäller allt levande, växter som djur – aminosyror och därmed peptider, enzymer och andra proteiner, enbart av den ena spegelbildsformen. Kolhydrater och nukleinsyror som DNA och RNA är andra exempel.
Enzymerna i våra celler är alltså kirala, liksom andra receptorer som är viktiga aktörer i cellernas maskineri. Det innebär att de binder företrädesvis den ena av de två enantiomererna till sig. Receptorerna är vanligtvis extremt selektiva – endast den ena enantiomeren passar i receptorns säte som nyckeln i ett lås. (Liknelsen härrör från en annan Nobelpristagare i kemi, Emil Fischer, som fick priset 1902.)
I och med att de båda enantiomererna av en kiral molekyl ofta har helt olika effekt i cellen, är det viktigt att kunna framställa de båda formerna i ren form var för sig.
Läkemedel och citrondoft
De flesta läkemedel består av kirala molekyler. Och eftersom läkemedlet måste passa ihop med de molekyler det ska binda sig till i cellerna, är det ofta den ena enantiomererna man är intresserad av. I vissa fall kan den andra formen till och med vara skadlig. Så var det t.ex. med läkemedlet talidomid, som såldes under 1960-talet till gravida kvinnor under namnet Neurosedyn. Den ena av enantiomererna av talidomid hjälpte mot illamående, medan den andra alltför sent upptäcktes kunna ge fosterskador.
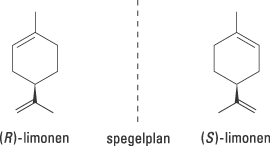
Det finns andra, mindre dramatiska, exempel på hur olika verkan de två enantiomererna kan ha i våra celler. Limonen, till exempel, är kiral men de båda enantiomererna kan vara svåra att se skillnad på vid en snabb titt (Fig. 2). Receptorerna i vår näsa är känsligare för spegelsymmetri – den ena formen luktar citron och den andra luktar apelsin.
 |
| Högupplöst bild (jpeg 42 kB) |
| Figur 2. (R)-limonen luktar apelsin medan (S)-limonen luktar citron. |
Katalytisk asymmetrisk syntes – vad är det?
För industrin är det mycket viktigt att kunna framställa så rena produkter som möjligt. Det är också viktigt att kunna få fram stora mängder av produkten, varför det är en förutsättning att det går att göra katalytiskt, dvs. med hjälp av ett ämne som påskyndar reaktionen utan att själv förbrukas.
Under de senaste decennierna har forskningen varit intensiv när det gäller att utveckla nya metoder för katalytisk asymmetrisk syntes, dvs. att katalytiskt framställa – syntetisera – företrädesvis den ena enantiomerern framför den andra. I en syntes bygger man från utgångsmolekyler (substrat) nya molekyler (produkter) med hjälp av olika kemiska reaktioner.
Det är forskare inom detta område som belönas med årets Nobelpris i kemi. Pristagarna har utvecklat kirala katalysatorer för två viktiga reaktionstyper inom den organiska kemin: hydrogenerings- och oxidationsreaktioner.
Knowles pionjärinsatser
Länge visste man inte om katalytisk asymmetrisk syntes överhuvudtaget var möjlig. Skulle det gå att katalysera en asymmetrisk reaktion som gav den ena enantiomeren i överskott? Genombrottet kom 1968 då William S. Knowles arbetade vid Monsanto Company, St. Louis, USA. Han upptäckte att man kunde använda en s.k. övergångsmetall för att ta fram en kiral katalysator som kunde överföra kiralitet till ett icke-kiralt substrat så att man fick en kiral produkt. Reaktionstypen kallas hydrogenering och går ut på att addera väteatomerna i H2 till kolen i en dubbelbindning. En enda katalysatormolekyl kan producera miljontals molekyler av den önskade enantiomeren.
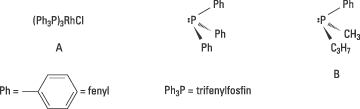
Knowles experiment byggde på två upptäckter som gjorts några år tidigare. Osborn och Wilkinson hade 1966 publicerat sin banbrytande syntes av ett lösligt övergångmetallkomplex, A i Fig. 3, som gav möjlighet att i lösning katalysera en hydrogenering. En sådan metod hade länge efterfrågats. Deras metallkomplex var inte kiralt. I komplexets mitt fanns övergångsmetallen rodium som band fyra grupper, ligander, till sig: tre trifenylfosfin-grupper och en klor.
Den andra upptäckten som Knowles pionjärinsatser vilar på, är Horners och Mislows synteser av kirala fosfiner, t.ex. den ena enantiomeren, B, som visas i Figur 3. Knowles idé var att det kanske skulle vara möjligt att få fram en katalysator för asymmetrisk hydrogenering om man bytte ut trifenylfosfin-grupperna i Osborn och Wilkinsons metallkomplex mot den ena av enantiomererna av en kiral fosfin.
Den fosfin som Knowles först använde var inte enantiomert ren, men gav ändå som produkt en blandning där det fanns 15% mer av den ena enantiomeren än den andra. Man säger att det enantiomera överskottet var 15%.
Högupplöst bild (jpeg 57 kB)
Figur 3. Knowles bytte i A ut den akirala fosfinen trifenylfosfin mot den kirala fosfinen B och erhöll en katalysator för asymmetrisk hydrogenering.
Trots att det enantiomera överskottet var blygsamt och knappast praktiskt användbart, visade resultatet ändå att det faktiskt var möjligt att åstadkomma katalytisk asymmetrisk hydrogenering. Andra forskare (Horner, Kagan, Morrison och Bosnich) kom kort därefter till liknande resultat och de har alla medverkat till att öppna dörren till ett nytt, spännande och viktigt forskningsfält för såväl akademisk som industriell forskning.
Den första industriella katalytiska asymmetriska syntesen
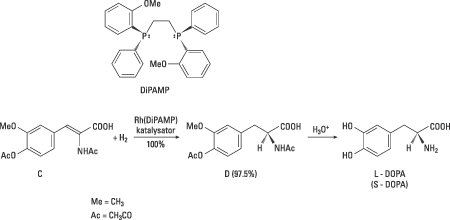
Knowles hade siktet inställt på att utveckla en industriell syntes av aminosyran L-DOPA, vilken visat sig användbar vid behandlingen av Parkinsons sjukdom – en upptäckt som för övrigt gav göteborgaren Arvid Carlsson förra årets Nobelpris i fysiologi eller medicin. Genom att pröva enantiomerer av fosfiner med varierad struktur lyckades Knowles tillsammans med sina medarbetare snabbt erhålla praktiskt användbara katalysatorer som gav högt enantiomert överskott, dvs. huvudsakligen L-DOPA. Den ligand som kom att användas i Monsantos industriella syntes av L-DOPA blev bifosfinliganden DiPAMP. Ett rodiumkomplex med denna ligand (Fig. 4) gav en blandning av enantiomererna av DOPA i kvantitativt utbyte och L-DOPA utgjorde 97.5% av produkten. Knowles hade därmed på kort tid lyckats med att omsätta andras och sin egen grundforskning till en industriell syntes av ett läkemedel. Den blev den första industriella katalytiska asymmetriska syntesen. Efterföljarna är många.
 |
| Högupplöst bild (jpeg 199 kB) |
| Figur 4. I den av Knowles och medarbetare utvecklade industriella syntesen av L-DOPA används föreningen C som startmaterial. I den kirala hydrogeneringen utnyttjades en av enantiomererna av DiPAMP. Produktenantiomeren D utgjorde 97.5% av produkten och efter syrahydrolys av D erhölls L-DOPA. |
Hur fungerar en kiral katalysatormolekyl?
Vilken roll spelar egentligen själva katalysatormolekylen i en asymmetrisk hydrogenering? Studier av bl.a. den oorganiske kemisten J. Halpern har klarlagt reaktionsmekanismen. Övergångsmetallen, t.ex. rodium i Fig. 4, som binder den kirala difosfinen har förmågan att samtidigt binda både H2 och substratet. Det erhållna komplexet reagerar därefter och H2 adderas till dubbelbindningen i substratet. Detta är det viktiga hydrogeneringssteget, då ett nytt kiralt komplex bildas, från vilket den kirala produkten frisätts. Från ett substrat som inte är kiralt har alltså kiralitet överförts från den kirala katalysatorn till produkten. Produkten innehåller mer av den ena enantiomeren än den andra, dvs. syntesen är asymmetrisk.
Orsaken till det enantiomera överskottet står att finna i hydrogeneringssteget. Vätet kan nämligen adderas via två vägar som ger de olika enantiomererna med olika hastighet. De två reaktionsvägarna utnyttjar olika övergångskomplex, som inte är spegelbilder av varandra, och därför har olika energi. Hydrogeneringen sker snabbare via komplexet med den lägsta energin och ger alltså den enantiomeren i överskott. Man kan likna detta vid händerna i ett handslag (Fig. 5). Händerna i ett handslag mellan två högerhänder passar bättre ihop än i ett handslag mellan en höger- och en vänsterhand. I utvecklingen av bättre asymmetriska hydrogeneringskatalysatorer gäller det att öka energiskillnaden mellan övergångskomplexen för att, som en konsekvens, erhålla större enantiomert överskott. Detta är inte minst viktigt för de industriella tillämpningarna, där man strävar efter ekonomi i processen och en miljömässigt acceptabel hantering, dvs. så få spillprodukter som möjligt. Denna utveckling har letts av en annan av årets kemipristagare, Ryoji Noyori.

Högupplöst bild (jpeg 218 kB)
Figur 5. Händerna till höger får symbolisera katalysatorn och händerna till vänster produkterna. I den övre bilden passar de bättre ihop (energin är lägre) än i den nedre bilden.
Noyoris generella hydrogeneringskatalysatorer
Den japanske forskaren Ryoji Noyori har gjort omfattande och intensiva forskningsinsatser som resulterat i bättre och mer generella katalysatorer för hydrogenering. Konsekvenserna av hans forskning är mycket stora.
Noyori och hans medarbetare publicerade 1980 en artikel om syntesen av de båda enantiomererna av difosfinliganden BINAP (Fig. 6). Dessa katalyserar i komplex med rodium syntesen av vissa aminosyror med upp till 100% enantiomert överskott. Företaget Takasago International använder BINAP i den industriella syntesen av det kirala aromämnet mentol sedan början av 1980-talet.
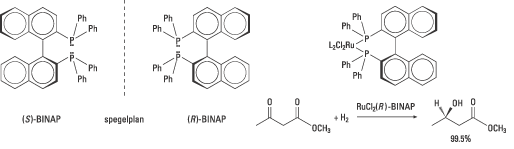 |
| Högupplöst bild (jpeg 231 kB) |
| Fig. 6. De båda enantiomererna av Noyoris användbara BINAP visas tillsammans med ett exempel på en stereoselektiv ketonreduktion där esterfunktionen lämnas intakt. |
Noyori insåg även behovet av mer generella katalysatorer med bredare tillämplighet. Att byta ut rodium, Rh(I), mot en annan övergångsmetall, rutenium Ru(II), visade sig till exempel vara framgångsrikt. Rutenium(II)-BINAP-komplex hydrogenerar många typer av molekyler med andra funktionella grupper. Reaktionerna ger höga enantiomera överskott, höga utbyten och kan skalas upp för industriellt bruk. Noyoris Ru-BINAP används som katalysator för att framställa (R)-1,2-propandiol i den industriella syntesen av ett antibiotikum, levofloxacin. Liknande reaktioner används för syntes av andra antibiotika. I Fig. 6 ges ett exempel på en stereoselektiv ketonreduktion.
Noyoris katalysatorer har fått bred användning för syntes av finkemikalier, farmaceutiska preparat och även nya avancerade material.
Sharpless kiralt katalyserade oxidationer
Parallellt med framstegen inom kiralt katalyserade hydrogeneringsreaktioner, har Barry Sharpless utvecklat motsvarande kirala katalysatorer för andra viktig reaktioner, nämligen oxidationsreaktioner. Medan hydrogenering avlägsnar en funktionell grupp i och med att dubbelbindningen mättas, så leder oxidation tvärtom till en ökad funktionalitet. Därmed skapas nya möjligheter att bygga komplexa molekyler.
Sharpless insåg att behovet av katalysatorer för asymmetriska oxidationer var stort. Han hade också idéer kring hur det skulle kunna åstadkommas. Han har gjort flera viktiga upptäckter som här exemplifieras med hans kirala epoxidering. År 1980 lyckades han med experimentet som ledde till en praktiskt användbar metod för katalytisk asymmetrisk oxidation av allyliska alkoholer till kirala epoxider. Reaktionen, som utnyttjade övergångsmetallen titan (Ti) och kirala ligander, gav höga enantiomera överskott. Epoxider är användbara mellanprodukter för olika typer av synteser. Metoden öppnar för stor strukturell diversitet och har fått mycket bred användning såväl inom akademisk forskning som industriellt. Framställning av epoxiden (R)-glycidol visas i Fig. 7.
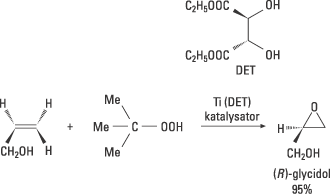
Högupplöst bild (jpeg 82 kB)
Figur 7. Den allyliska alkoholen oxideras till epoxiden (R)-glycidol med oxidationsmedlet tertiärbutylhydroperoxid i närvaro av en katalysator. Katalysatorn bildas i reaktionsblandningen från titantetraisopropoxid och den naturligt förekommande D-vinsyrans dietylester. Metallen binder samtidigt till sig den kirala liganden, hydroperoxiden och substratet, varefter den kirala epoxideringen äger rum.
Glycidol används i läkemedelsindustrin för att framställa s.k. Beta-blockerare, som används som hjärtmediciner. Många utpekar Sharpless epoxidering som den viktigaste reaktionsupptäckten under de senaste decennierna.
Konsekvenser och tillämpningar
Några av tillämpningarna av pristagarnas banbrytande insatser har vi redan berört. Det är särskilt viktigt att betona den stora betydelse som deras upptäckter och förbättringar inneburit industriellt. Nya läkemedel är den viktigaste tillämpningen, men vi kan även nämna framställningen av smak- och luktämnen, sötningsmedel och produkter för insektsbekämpning, t.ex. feromoner. Årets Nobelpris i kemi visar att steget från grundforskning till industriell tillämpning ibland kan vara kort.
Runt om i världen sysslar många forskargrupper nu med att utveckla andra katalytiska asymmetriska synteser inspirerade av pristagarnas upptäckter. Insatserna som belönas med årets Nobelpris i kemi har givit mycket viktiga redskap till den akademiska forskningen och bidrar därmed till att snabbare flytta forskningsfronterna framåt – inte bara inom kemin, utan också inom materialvetenskapen, biologin och medicinen. Deras insatser ger tillgång till nya molekyler som behövs för att utforska hittills oupptäckta eller oförklarade fenomen i molekylernas värld.
Pristagarna
William S. Knowles
84 år, född 1917, (amerikansk medborgare). Doktorerade 1942 vid Columbia University. Tidigare verksam vid Monsanto Company, St Louis, USA.
Pensionerad sedan 1986.
Ryoji Noyori
63 år, född 1938 i Kobe, Japan (japansk medborgare). Doktorerade 1967 vid Kyoto University. Sedan 1972 professor i kemi vid Nagoya University och sedan förra året ledare för Research Center for Materials Science, Nagoya University, Nagoya, Japan.
K. Barry Sharpless
60 år, född 1941 i Philadelphia, Pennsylvania, USA (amerikansk medborgare). Doktorerade 1968 vid Stanford University. Sedan 1990 innehar han W.M. Keck-professuren i kemi vid the Scripps Research Institute, La Jolla, USA.
Play a game!
Chiral objects, like left and right hands, cannot be superimposed on its mirror image. Find other ‘chiral’ objects in this game.
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 12 laureates' work and discoveries range from proteins' structures and machine learning to fighting for a world free of nuclear weapons.
See them all presented here.
